Liebe Exkursionteilnehmer*innen,
auf dieser Seite findet ihr alle wichtigen Informationen zum Exkursionsangebot im Rahmen der Veranstaltung „Regionale außerschulische Lernorte Oberschwabens“.
In der folgenden Übersicht haben wir die geplanten Exkursionsorte und -zeiten angegeben. Sollten einige Teilnehmer*innen auf öffentliche Verkehrsmittel angewiesen sein, müssen wir die Exkursionsziele eventuell ändern. Dies werden wir auf der ersten Veranstaltung in Oberteuringen klären.
Ausrüstung: Außer einer exkursionsgerechten Kleidung
- Schreibzeug und Notizbuch
- Mobiltelefon mit Fotofunktion,
- Botanikerlupe und Fernglas
- Behälter (Stofftasche oder Plastikbeutel; kleine Sammelbehälter ) zum Unterbringen von Sammlungsstücken
- eventuell eine Sitzunterlage für Pausen im Gelände
Studienleistungen: Portfolio zu den Exkursionen, in dem zu jeder Exkursion mindestens zwei Objekte, Themen, Aktivitäten … beschrieben und kommentiert werden. Bei den Objekten können auch Scans oder Fotos verwendet werden, sodass auch ein digitales Portfolio möglich ist.
Artenkenntnis : Wichtiges Ziel der Exkursionen ist die Verbesserung der Artenkenntnis. Deshalb werden auf jeder Exkursion von zwei Teilnehmenden alle angesprochenen Arten notiert. Sie werden anschließend auf dieser Homepage veröffentlicht.
Kommentare und Fragen sind erwünscht, während den Exkursionen, als Kommentar auf dieser Seite oder per E-Mail. Wenn sie Pflanzen- oder Tierarten betreffen, ist ein beigefügtes Foto hilfreich.
Die erste Veranstaltung findet am 8. Mai in Oberteuringen statt. Von Weingarten/Ravensburg aus ist der Ort über die B 33 (Richtung Meersburg) zu erreichen. Außerdem gibt es eine Busverbindung von Ravensburg nach Oberteuringen, die ihr unter folgender URL finden könnt:
https://www.rome2rio.com/de/map/Ravensburg/Oberteuringen
https://www.rome2rio.com/de/map/Oberteuringen/Ravensburg
Auf die Exkursionen freuen sich Sabrina Brendle und Wilfried Probst.
Übersicht über die Exkursionsorte und -termine

| Zeit | Treffpunkt | Themen |
| 8.5.21 13.30-17.30h | Oberteuringen, Franz-Roth-Platz | Baumgeschichten; Bestimmungsschlüssel; Suchen und Finden; Kletterpflanzen; Wiese |
| 15.5.21 10.00-14.00 | Weingarten, Freibad | Natur wahrnehmen und erleben |
| 29.5.21 13.30-17.30h | Oberteuringen, NSG Altweiherwiese* | Landschaftsgeschichte; Gräser; Zeigerwerte von Pflanzen; Saumbiotope; Biber |
| 12.6.21 10.00-1400h | Völlkofen, Grillhütte | Wildkräuter und ihre Verwendung |
| 3.7.21 13.30-17.30h | Wilhelmsdorf, Naturschutzzentrum | Insekten, Landschaftsgeschichte:Hoch- und Niedermoor |
| 24.7.21 18.30-22.30h | Wilhelmsdorf, Naturschutzzentrum | Fledermäuse |
8. Mai 2021 Oberteuringen
Anfahrt zum Treffpunkt in Oberteuringen, Franz-Roth-Platz
1. Von Ravensburg auf der B 33 Richtung Meersburg bis Oberteuringen, Ortsteil Hefigkofen und weiter bis Ortsteil Neuhaus.
2. In Neuhaus an der ersten Kreuzung links in die Teuringer Straße abbiegen.

3. Der Straße bis zum Ortsschild „Oberteuringen“und bis zur 30iger Zone folgen, dann erste Abzweigung links zum Parkplatz „Franz-Roth-Platz“ abbiegen.

Vorlagen: Google maps
Oberteuringen
Oberteuringen ist ein Beispiel für die lange Besiedelungsgeschichte Oberschwabens und des Bodenseegebietes. Die älteste Urkunde, welche die Existenz der Siedlung Teuringen belegt, stammt aus dem Jahre 752. Dabei handelt es sich um einen Beleg für die Schenkung Teuringens und einiger anderer Siedlungen an das Kloster St. Gallen. Eine solche lange Geschichte ist durchaus charakteristisch für Ortschaften deren Namen mit – ingen endet. Dabei handelt es sich um alemannische Siedlungen die vermutlich im fünften und sechsten Jahrhundert gegründet wurden und mit denen die intensivere landwirtschaftliche Bewirtschaftung Oberschwabens begann. Diese lange Siedlungsgeschichte war landschaftsprägend. Rund um die vielen kleinen Ortschaften, Weiler und Einzelhöfe ist eine reich strukturierte Landschaft entstanden. Große zusammenhängende Waldgebiete sind selten, auch die landwirtschaftlichen Flächen sind meist kleiner strukturiert. Erst die Industrialisierung in jüngerer und jüngster Zeit hat viele Ortschaften durch Gewerbegebiete und neue Wohngebiete sehr anwachsen lassen. Das gilt auch für Oberteuringen, das mittlerweile über 5000 Einwohner zählt und gerade neue Bebauungspläne aufstellt.
Ein Grund dafür, dass der erste außerschulische Lernort unserer Exkursionen ein solcher aus biologischer Sicht eher durchschnittlich erscheinender Ort Oberschwabens ist und nicht ein spektakuläres Naturschutzgebiet wie der Federsee oder das Wurzacher Ried, liegt daran, dass wir zeigen wollen, dass ergiebige außerschulische Lernorte eigentlich überall zu finden sind, ein zweiter, dass ich seit 14 Jahren in Oberteuringen wohne.
Literatur: Sanktjohanser, G. K. -Hrsg. (2002): Obeteuringen – Ein Streifzug durch die Jahrhunderte. Gemeinde Oberteuringen

Oberteuringen liegt an der Rotach, etwa in der Mitte ihres knapp 40 km langen Laufes über etwa 225 Höhenmeter vom Pfrunger-Burgweiler Ried bis zum Bodensee bei Friedrichhafen. Nach Argen und Schussen ist die Rotach der dritte größere Zulauf in den nordöstlichen Bodensee. Dieser kleine Fluss macht in Oberteuringen einen durchaus naturnahen Eindruck, der aber vor allem Renaturierungsmaßnahmen zu verdanken ist. Ursprünglich standen an der Rotach 22 Mahl- und Sägemühlen, die Oberteuringer Mühle beherbergt mittlerweile das Teuringer Kulturzentrum. Das Betreiben dieser Mühlen erforderte viele wasserbauliche Maßnahmen mit Stauwehren und Kanälen, die den natürlichen Bachlauf stark veränderten.

Besondere Bäume am Sankt Martinsplatz
Der heutige Kirchenbau Sankt Martinus stammt aus der Zeit 1516/1517, der Ort war aber schon lange vorher der Standplatz einer christlichen Kirche. 1846 erhielt der Kirchturm seine heutige weithin sichtbare, über 60 m hohe Spitze. Der Platz zwischen Kirche und Rathaus, der Sankt Martinsplatz, ist das Zentrum Oberteuringens.
Unser Interesse galt vier besonderen Baumarten am Sankt Martinsplatz. Jeweils eine Gruppe beschäftigte sich kurze Zeit mit einer der Arten und versuchte, sie in einer möglichst kurzen Form eindeutig zu charakterisieren. Zwei „ahnungslose“ hielten sich während dessen außer Sichtweite auf. Dann versammelten sich alle vor dem Rathaus und die Gruppen charakterisierten ihren Baum. Alle vier Bäume wurden – es war zugegebenermaßen nicht sehr schwierig – sofort erkannt.
Gewöhnlicher Trompetenbaum (Catalpa bignonioides)


Weitere Namen: Zigarrenbaum, Bohnenbaum; der Name ist aus der Sprache der Cherokee übernommen und bedeutet „Bohnenbaum“.
Heimat: Südosten der Vereinigten Staaten, vor allem in Auwäldern und an Flussufern, 1726 durch den englischen Naturforscher Mark Catesby (1683-1749) von Carolina nach Europa gebracht.
Der Baum kann 15-18 m hoch werden. Alte Trompetenbäume bilden Absenkeräste, die einwurzeln (auf der Insel Mainau zu sehen!) und damit der Ausbreitung dienen.
Die herzförmigen bis schwach gelappten, glattrandig Blätter treiben erst sehr spät aus. Beim Zerreiben riechen sie unangenehm. In letzter Zeit kommt es in Deutschland zur Auswilderung, was vermutlich mit der Klimaerwärmung zusammenhängt.
Das Verbreitungsgebiet von Catalpa deckt sich etwa mit dem ursprünglichen Siedlungsgebiet Chirokee und vier weiterer Indianerstämme, die wegen ihrer Anpassung an die Lebensweise der Kolonisten auch als die „ Fünf zivilisierten Nationen“ bezeichnet wurden. Sequoyah (1763-1843), Sohn einer Cherokee-Indianerin und eines europäischen Händlers erfand die Cherokee Schrift, die heute noch für die Cherokee-Sprache verwendet wird. Der Mammutbaum Sequoia sempervirens wurde nach ihm benannt. Der Vertrag von New Echota von 1835 führte zur Vertreibung der Cherokee aus dem südöstlichen Waldland in Carolina und Georgia in ein karges Territorium im Staate Oklahoma. Bei dieser gewaltsamen Umsiedlung, die als „Trail of Tears“ in die Geschichte eingegangen ist, kamen vermutlich um die 8000 der Deportierten ums Leben (teilweise nach Wikipedia).
Purpur-Magnolie (Magnolia liliiflora)

Heimat: China (Prov. Yunnan und Hubei); als Zierbaum in China weit verbreitet.
Das Gehölz ist meistens fast von der Basis an verzweigt und erreicht etwa 5m Wuchshöhe. Die Krone ist meist breit, Stamm und Äste sind oft unregelmäßig gekrümmt. Die Zweige sind hellgrau bis braun und nicht behaart. Auch an dickeren Stämmen bleibt die graue Rinde glatt.
Die Magnolien (Magnolia) sind eine Pflanzengattung der Familie der Magnoliengewächse mit über 200 Arten in Ostasien und Nordamerika. Ihren Namen gab ihr Linné zu Ehren des französischen Botanikers Pierre Magnol (1638–1715). Einige Magnolien haben sind beliebte Ziergehölze vor allem die Stern-Magnolie und die Tulpen-Magnolie, ein Hybrid aus Magnolia denudata und Magnolia liliiflora.
Magnolien sind sehr ursprüngliche Blütenpflanzen. Bei einer auf genetischen Analysen beruhenden Rekonstruktion einer Urblüte kam eine Blüte heraus, die dem Habitus der heutigen Magnolienblüten sehr ähnlich sieht.

Gewöhnlicher Judasbaum (Cercis siliquastrum)

Heimat: Südeuropa bis Vorderasien
Angeblich hat sich Judas an einem solchen Baum erhängt. Andere Namen: Salatbaum, Liebesbaum, Stammhülsenbaum
Die Gattung hat einen Verbreitungsschwerpunkt in China (5 Arten), 4 Arten kommen in Nordamerika und eine in Zentralasien vor.
Typisch ist die Kauliflorie (Stammblütigkeit). Die biologische Erklärung ist, dass dies auch schwerere Tiere wie Kleinsäugern und Vögeln die Bestäubung ermöglicht. Kauliflore Pflanzen gibt es fast nur bei tropischen Pflanzen.
Gemeindemitteilungen Oberteuringen,20.11.20
Aus unserer Gemeinde
Der von Michaela und Manuel Knöpfler gespendete Cercis reniformis (= C. canadensis*) -Baum, auch Ju-dasbaum genannt, verschönert ab sofort den Vorplatz der Kirche St. Martin und soll als Zeichen des Lebens gerade in diesen Zeiten Mut machen. Auch wenn der Baum ausgerechnet den Namen des Jün-gers trägt der Jesus verraten und an die Römer ausgeliefert hat, nahm Jesus Schicksal durch ihn seinen Lauf. Mit seiner Auferstehung finden wir heute Hoffnung im Glauben auf das ewige Leben. Der Baum steht zwischen 2 Bänken, die bereits im Jahr 2011 ebenfalls von Michaela und Manuel Knöpfler gespendet wurden. Diese laden zum Innehalten ein und ermöglichen den Blick auf die wunderschöne Kirche St. Martin.
*Die Blattform spricht dafür, dass es sich bei der Art um Cercis siliquastrum handelt (W. Probst)
In dem gemulchten Beet, in dem der Judasbaum steht, entdeckten wir den Fruchtkörper einer Spitz-Morchel (Morchella elata).

Lawsons Scheinzypresse, Oregon-Scheinzypesse (Chamaecyparis lawsoniana)
(nach dem schottischen Botaniker Peter Lawson benannt)

Heimat: Südwest-Oregon und Nordwest-Kalifornien.
Der Unterschied zu den Echten Zypressen (Cupessus) besteht darin, dass Scheinzypressen stärker abgeflachte Zweige und zweierlei schuppenartige Blätter sowie kleinere, kugelige Zapfen besitzen und Samen früher reifen. Die ebenfalls sehr ähnlichen Lebensbäume (Thuja) haben im Gegensatz zu den Scheinzypressen kleine, längliche Zapfen. Die etwa fünf Arten (Chamaecyparis) sind in den nördlicheren Breiten Nordamerikas und Ostasiens verbreitet. Die Oregon-Scheinzypresse kann in ihrer Heimat bis 65 m hoch werden – so hoch wie der Kirchturm von St. Martin!
Das hellgelbe, harzfreie Holz wird für Schiffsbau und Möbel verwendet. In Europa ist der Baum, von dem es zahlreiche Sorten gibt, ein häufiges Ziergehölz. Mittlerweile gibt es wild wachsende Vorkommen.
Artenarmut mitteleuropäischer Wälder im Vergleich mit Nordamerika und Ostasien
In Mitteleuropa gedeihen viele Gehölzarten aus Nordameria oder dem nördlichen Ostasien, die dort unter ähnlichen Klimabedingungen wie hier existieren können. Dies hängt damit zusammen, dass die Waldvegetation Mitteleuropas während der vor etwa 2,6 Millionen Jahren beginnenden Kaltzeiten fast vollständig vernichtet wurde. Im Gegensatz zu Ostasien und Nordamerika, wo die Hauptgebirgsketten vorwiegend von Norden nach Süden verlaufen,war der Vegetation Mitteleuropas beim Vordringen der kaltzeitlichen Gletscher ein Rückzug nach Süden durch die Alpenkette weitgehend versperrt. Darin sieht man den Grund dafür, dass die mitteleuropäische Gehölzvegetation sehr viel artenärmer ist, als die entsprechenden Pflanzengesellschaften in Nordamerika und Ostasien. Im Pliozän, vor dem Beginn der Kaltzeiten (des Pleistozäns) kamen viele der heute bei uns angepflanzten Arten oder nahe Verwandte dieser Pflanzen auch in Mitteleuropa vor. Dies ist ein Argument mancher Forstleute, nun in Mitteleuropa die Aufforstung mit amerikanischen und asiatischen Baumarten zu versuchen, die mit dem Klimawandel besser zurechtkommen könnten.
Gehölze an der Rotach
Im Ortsgebiet von Oberteuringen wird die Rotach von einer Vielfalt einheimischer Gehölze gesäumt. Wir lernten sie kennen, indem wir für sie einen Bestimmungsschlüssel bastelten.


Die Aufgabe besteht nun zunächst darin, zu jedem der sechs hier grün markierten Endpunkte des Bestimmungsganges Beispiele zu finden. Alle Blätter, die zu einer Art gehören, werden auf einem Haufen angeordnet. Anhand der gefundenen Blätter werden mögliche Merkmalsalternativen zur weiteren Bestimmung besprochen. Alle Arten werden mit Namen beschriftet.

Fotos A. Winter
Seifenkraut (Saponaria offcinalis)
Am Wegrandentdecken wir einen großen Bestand des Seifenkrautes. Das Nelkengewächs wird von einer Teilnehmerin, die sich sehr gut auskennt, entdeckt, obwohl die zart rosavioletten Blüten noch lange nicht entwickelt sind. Der Name der Pflanze weist auf ihre frühere Verwendung als Seifenersatz hin. Alle Pflanzenteile insbesondere die Wurzelstöcke enthalten Wasseroberflächen-entspannende Triterpensaponine. Wir zerreiben einige Triebe und schütteln Sie in einem Behälter mit Wasser und wir können die Schaumbildung beobachten.
Seifenkraut-Extrakte werden bis heute bei der schonenden Reinigung von alten Textilien und Möbelstücken verwendet (Wikipedia).
Foto A. Winter
Suchen und finden
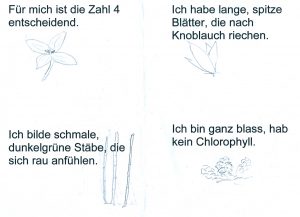
Alle Teilnehmenden erhalten eine Suchkarte für eine Pflanzenart:
Die Arten werden ziemlich schnell gefunden: Bär-Lauch (Allium ursinum), Winter-Schachtelhalm (Equisetum hiemale), Einbeere (Paris quadrifola), Schuppenwurz (Lathraea squamaria). Letztere ist ein völlig Chlorophyll-freier Parasit an Laubbäumen.

Kletterpflanzen
Je höher eine Pflanze wächst, desto kräftiger muss ihr Stamm sein. Aber das gilt nicht für alle! Kletterpflanzen nutzen die Stabilität ihrer Unterlagen.
Bei der Brücke über die Rotach wachsen zwei Kletterpflanzen-Arten, die verholzte Liane Gewöhnliche Waldrebe (Clematis vitalba) und der krautige, jedes Jahr neu aus dem unterirdischen Wurzelstock auswachsende Echte Hopfen (Humulus lupulus). Die Waldrebe hält sich mit ihren rankenden Blattstielen an der Unterlage fest, der Hopfen windet mit seiner Sprossachse um die Unterlage, und zwar so, dass in der Seitenansicht ein S zu erkennen ist (Rechtswinder). Diese Richtung des Winden ist bei Kletterpflanzen im allgemeinen genetisch festgelegt, d. h. die Pflanzen können nur nach rechts oder nach links winden. Bei Linkswindern erkennt man in der Seitenansicht ein Z.
Lianen können hoch in Bäume hinaufklettern und viel Laubwerk entwickeln, dabei bleiben ihre Sprossachsen viel dünner als die Stämme der Bäume. Sie müssen aber fast gleich viel Wasser transportieren. Deshalb ist es wichtig, dass ihre Wasserleitungsbahnen sehr effektiv sind. Lianen haben deshalb die weitesten Tracheen aller Pflanzen (Durchmesser bis 0,7 mm). Auch die Leitungsbahnen der Waldrebe kann man schon mit bloßem Auge sehen. Wir schneiden einen etwa 1,50 m langen Sprossabschnitt der Waldrebe heraus: es gelingt ohne Mühe, durch diesen Stab Luft in ein Wasserglas zu blasen. Bei der Erweiterung der Leitungsbahnen gibt es allerdings eine Grenze: Werden die Durchmesser zu groß, reichen die Adhäsion und Kohäsionskräfte der Wassermoleküle nicht mehr aus um den hydrostatischen Unterdruck auszugleichen. Es bilden sich Luftblasen und die Wassersäule reist ab („Gasembolie“).

Wiesen
Wiesen und Weiden sind in unserem Klima fast ausschließlich Folgen landwirtschaftlicher Nutzung. Sie können sich nur halten, wenn sie regelmäßig von Weidetieren abgefressen oder gemäht werden. Aber sie machen mittlerweile in Mitteleuropa 50 % der landwirtschaftlich genutzten Fläche und 20 % der Gesamtfläche aus. Die Art der Bewirtschaftung ist für die Biodiversität entscheidend.
Typisch für Wiesen ist ihre Schichtung. Ähnlich wie die Frühjahrsblüher im Wald so haben die Wiesenpflanzen der Unterschicht ihre beste Entwicklungsmöglichkeiten im Frühjahr, wenn die Wiese noch nicht hoch gewachsen sind.
Wir sortieren die Wiesenpflanzen nach der Zugehörigkeit zur Unterschicht, Mittelschicht und Oberschicht.

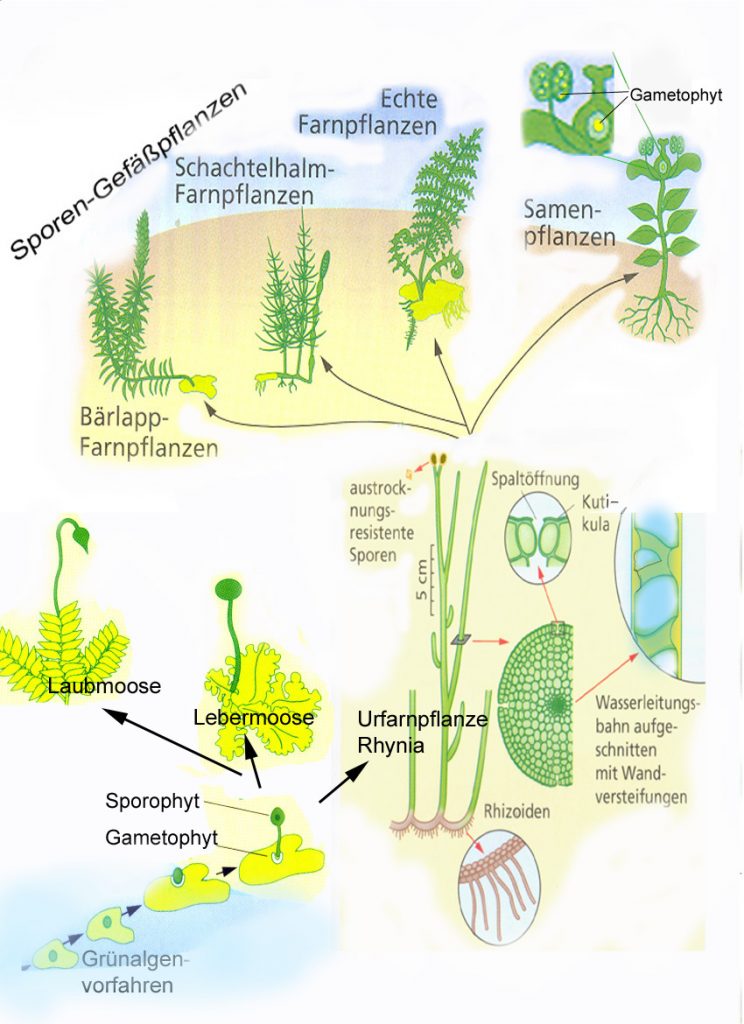
Die ersten Landlebewesen
Auf dem Weg zurück zum Ortszentrum bzw. zum Franz-Roth-Platz kommen wir an eine vertetene ziemlich feuchte Wegstelle mit eigenartig schwärzlichen Belägen, die mit Wasser zu olivfarbenen Gallertklumpen aufquellen. Es handelt sich um das Blaugrüne Bakterium Nostoc. So ähnlich könnten die ersten Lebewesen ausgesehen haben, die vor mehr als 3 Milliarden Jahren das Festland besiedelten.
Foto W. Probst
Artenliste
(Zusammengestellt von Jennifer Friedrich)
Bäume auf dem Kirchplatz:
Trompetenbaum (Catalpa bignonioides)
Purpur-Magnolie (Magnolia liliflora)
Judasbaum (Cercis siliquastrum)
Lawsons Scheinzypresse (Chamaecyparis lawsoniana)
Im Beet beim Judasbaum:
Vielblütige Weißwurz (Polygonatum multiflorum)
Spitz-Morchel (Morchella elata) – Schlauchpilz
Bäume und Sträucher aus dem Bestimmungquiz:
Blätter gefiedert:
Schwarzer Holunder (Sambucus nigra)
Gemeine Esche (Fraxinus excelsior)
Echte Walnuss (Juglans regia)
Blätter handförmig gelappt:
Spitz-Ahorn (Acer platanoides)
Berg-Ahorn (Acer pseudoplatanus)
Feld-Ahorn (Acer campestre)
Gemeiner Schneeball (Viburnum opulus)
Gemeiner Efeu (Hedera helix)
Blätter nicht handförmig gelappt:
Stiel-Eiche (Quercus robur)
Blätter nicht gelappt, Rand glatt:
Roter Hartriegel (Cornus sanguinea)
Weide – Salix spec.
Rote Heckenkirsche (Lonicera xylosteum)
Gewöhnlicher Liguster (Ligustrum vulgare)
Blätter nicht gelappt, gesägt/gezähnt:
Berg-Ulme (Ulmus glabra)
Gewöhnliche Traubenkirsche (Prunus padus)
Schwarz-Erle (Alnus glutinosa)
Eberesche (Vogelkirsche) (Sorbus aucuparia)
Gemeine Hasel (Corylus avellana)
Europäisches Pfaffenhütchen (Euonymus europaeus)
Weitere Arten:
Selbstkletternde oder Fünfblättrige Jungfernrebe – (Parthenocissus quinquefolia) Gewöhnliches Seifenkraut (Saponaria officinalis)
Gewöhnlicher Giersch (Aegopodium podagraria)
Wasseramsel (Cinclus cinclus) – haben wir auf der Exkursion zwar nicht gesehen, kann hier aber regelmäßig beobachtet werden. Immer wieder hörten wir den Gesang von Amsel, Buchfink, Zilp-Zalp (Weidenlaubsänger) und Mönchsgrasmücke
Kletterpflanzen
Echter Hopfen (Humulus lupulus) (S-Winder)
Gewöhnliche Waldrebe (Clematis vitalba) (Z-Winder; außerdem dienen die Blattstiele und Spindeln zwischen der Fiedern als Ranken)
Suchspiel mit Karten:
Gewöhnliche Schuppenwurz (Lathraea squamaria)
Vierblättrige Einbeere (Paris quadrifolia)
Winter-Schachtelhalm (Equisetum hyemale)
Bär-Lauch (Allium ursinum)
Auf der Streuobstwiese:
Oberes Wiesenstockwerk/Wiesenschicht:
Wiesen-Sauerampfer (Rumex acetosa)
Scharfer Hahnenfuß (Ranunculus acris)
Wiesen-Labkraut (Galium mollugo)
Stumpfblättriger Ampfer (Rumex obtusifolius)
Gold-Kälberkropf (Chaerophyllum aureum)
Gewöhnliches Knäuelgras (DactylIs glomerata)
Mittelschicht:
Gewöhnliches Ruchgras (Anthoxanthum odoratum)
Wiesen-Schaumkraut (Cardamine pratensis)
Wiesen-Rispengras (Poa pratensis)
Unterschicht:
Gewöhnlicher Löwenzahn (Taraxacum sect. Ruderalia) (Taraxacum officinale)
Zaun-Wicke (Vicia sepium)
Wiesen-Klee (Rotklee) (Trifolium pratense)
Faden-Klee (Kleiner Klee) (Trifolium dubium)
Kleine Braunelle (Prunella vulgaris)
Kriechender Günsel (Ajuga reptans)
Gundermann (Glechoma hederacea)
Scharbockskraut (Ficaria verna )
Kriechendes Fingerkraut (Potentilla reptans)
Quellen-Hornkraut (Cerastium fontanum)
Quendel-Ehrenpreis (Veronica serpyllifolia)
Faden-Ehrenpreis (Veronica filiformis)
Spitz Wegerich (Plantago lanceolata)
Auf dem Rückweg
Nostoc sp.; gehört zu den Cyanobakterien
15. Mai 2021 Weingarten
Treffpunkt: Eingang zum Freibad.
Natur wahrnehmen und erleben
„Wenn wir eine Gesellschaft schaffen wollen, die die Natur wirklich liebt und ihr mit Ehrfurcht begegnet, müssen wir den Mitgliedern dieser Gesellschaft Erlebnisse in der Natur anbieten, die ihr Leben verändern.“ Joseph Cornell
Längst ist bekannt, dass das reine Wissen über die Bedrohung und die Schutzwürdigkeit der Natur allein nicht ausreicht. Aus diesem Grund stand die Exkursion am 15. Mai 2021 unter dem Thema „Natur wahrnehmen und erleben“.
Innerhalb der 4 Stunden mussten die Studierende der Pädagogischen Hochschule alle ihre Sinne einsetzten. Der Tag begann zunächst mit kleineren Kennenlernspielen um wach zu werden und die eigene Konzentration hochzufahren.
Hören
Der erste Sinn, das Hören, wurde als erstes angesprochen. Die Studierende sollten bei der Aktion „Geräusche hören“ sich auf ihr Gehör verlassen und die Geräusche in ihrer Umwelt wahrnehmen. Schritt für Schritt wurden sie an die Aktion herangeführt. Zunächst durften sie einfach darauf los hören, danach wurden gezielte Aufgaben gestellt um das Gehör zu schulen. Die Studierende stellten mit erstaunen fest, dass es anfangs gar nicht so leicht war, mit etwas Übung die Geräusche jedoch lauter und deutlicher wurden.
Tasten
Der Tastsinn war als nächstes an der Reihe. Nachdem die einzelnen Teilnehmer einen Naturgegenstand in die Hand gelegt bekommen und diesen erfühlt hatten, gingen sie auf die Suche, ihren Partner mit dem gleichen Gegenstand zu finden. Hier stolperten die Studierende über die Schwierigkeit, die richtigen Worte für ihren Gegenstand zu finden. Aber auch hier wurden die Fähigkeiten schnell immer besser, sodass jeder seinen Partner fand, und sie zu Zweit in die nächste Aktivität konnten… „Bäume fühlen“. Zunächst sollte jeweils einer des Teams, blind in den Wald geführt werden und durch „Schwingungen“ erfühlen, wo der nächste Baum sich befand. In der zweiten Runde durften die Teilnehmer einen Baum mit ihren Händen erfühlen und diesen so kennenlernen. Die Studierenden berichteten begeistert davon, dass es zwar nicht immer leicht war, aber jeder Baum dennoch etwas Einzigartiges an sich hatte, an dem man ihn durchaus wiedererkennen würde.
Sehen
Die dritte Aktivität zielte auf das Sehen ab. Mit der Aktion „Umwelt im Umschlag“ wurden die Studierenden gezielt mit konkreten Aufgaben los geschickt um ihre Umwelt zu untersuchen und Gegenstände mitzubringen. Bei der Nachbesprechung und der Entwicklung weiterer möglicher und interessanter Fragen, brachte Noemi (ich hoffe an dieser Stelle, den richtigen Namen genannt zu haben) die Idee ins Spiel, den Geruchsinn mit anzusprechen. „Sammle mindestens 5 Dinge, die typisch nach Wald riechen.“ Gesagt, getan…
Gleichgewicht
Der letzte Sinn an diesem Tag war der Gleichgewichtssinn. Mit dem Spiel „Der schlafende Geizhals“ sollten die Studierende einem schlafenden Geizhals, welcher mit einer Wasserspritzflasche bewaffnet war, auf möglichst leisen Sohlen, die Schokolade, die vor ihm auf dem Waldboden lag, abnehmen. Gar nicht so einfach, wenn es bei jedem Schritt und Tritt knackst und raschelt.
Resumee
Nach einer schnellen Runde „Luftballon-Resümee“ war der Tag auch schon wieder vorbei.
„Ich habe heute gelernt, ohne zu merken, dass ich etwas lerne.“
29. Mai 2021 Obrteuringen, NSG Altweiherwiese
Treffpunkt an der Unterführung der Straße nach Bibruck unter der L 329 nach Meckenbeuren
1. Anfahrt von Ravensburg bis Oberteuringen auf der B33 bis Oberteuringen Ortsteil Hefigkofen
2. Dort am Gasthaus Adler nach links abbiegen Richtung Meckenbeuren
3. Der Straße folgen bis zur Abzweigung einer kleinen Straße links nach Bibruck


Zum Naturschutzgebiet Altweiherwiese
Das 78 ha große Naturschutzgebiet Altweiherwiesen wurde 1981 vom Regierungspräsidium Tübingen ausgewiesen. Es liegt nordöstlich von Oberteuringen auf einer Meereshöhe von rund 450 m.
Im späten Mittelalter legten hier Mönche des Klosters St. Gallen durch Aufstau des Taldorfer Baches in Höhe der heutigen L329 einen Fischweiher an. Mitte des 18. Jahrhunderts wurde der Teich abgelassen und die feuchten Niederungen wurden bis Mitte des 20. Jahrhunderts als Streuwiesen genutzt. Heute werden die Wiesen von Naturschutz regelmäßig gemäht und das Mähgut wird entfernt. Dadurch wird das Mineralstoffangebot niedrig gehalten und das Aufkommen von Gehölzen verhindert.
Das umgebende Landschaftsschutzgebiet „Altweiherwiese und Taldorfer Bach“ soll das Naturschutzgebiet gegen störende Einflüsse von der Umgebung abschirmen.
Zur Landschaftsgeschichte
Auf einer topographischen Karte und noch deutlicher in einem digitalen Geländemodell erkennt man, dass das Naturschutzgebiet Altweiherwiese in der Fortsetzung eines Tals liegt, dass eine Verbindung zwischen Schussenbecken und der Niederung südlich des Gehrenbergs darstellt. Dabei handelt es sich um eine alte Schmelzwasserrinne, die am Ende der letzten Kaltzeit vor etwa 15.000 Jahren am damaligen Gletscherrand entstand. Dieses Rückzugsstadium des Gletschers, das sich einige Zeit hielt und kleine Endmoränen ablagerte, wird auch als Konstanzer Stadium bezeichnet. Die Schmelzwasserrinne war ein Teil der Ur-Argen, in der sich die Schmelzwasser vom nördlichen Gletscherrand sammelten und dem damals schon in Teilen existierenden Überlinger See zuflossen. In der Schmelzwasserrinne kam es immer wieder zu kleinen Aufstauungen, und Seenbildungen und darin zu Ablagerungen von Feinmaterial. Dadurch entstanden gegen das eiszeitliche Schottermaterial abgedichtete Bereiche, über denen es zu Torfbildung kommen konnte.

Heute wird die breite Talniederung von dem kleinen Taldorfer Bach durchflossen
Gräser
Gräser sind keine besonders auffälligen Pflanzen. Als Windbestäuber fehlen ihnen auffällige Blüten. Auf den ersten Blick kann man deshalb die verschiedenen Arten nur schwer unterscheiden. Bei genauem Hinsehen lassen sich jedoch meistens gute Bestimmungsmerkmale finden.
Zunächst probieren wir, ob man Grasarten auch blind unterscheiden kann, wenn man sie im Gesicht fühlt oder mit den Fingern ertastet. Es zeigt sich dass dies erstaunlich gut funktioniert, insbesondere, da bestimmte Merkmale, die man leicht übersieht – wie samtige Behaarung oder feine Grannen – sich ganz gut ertasten lassen.
Dann werden die verschiedenen Bestimmungsmerkmale der Süßgräser (Familie Poaceae) mithilfe eines Puzzles und realen Gräsern vorgestellt:
Blütenstand und Blüte
Als Einheit der Grasblütenstände gilt das Ährchen, das aus einer bis vielen Blüten bestehen kann. Diese Ährchen sind charakteristischerweise in einer Rispe angeordnet, seltener können die einzelnen Ährchen auch direkt an der Hauptachse sitzen, dann spricht man von einem Ährengras. Manchmal sind die Listen Äste sehr kurz, sodass der Blütenstand – obwohl er stärker verzweigt ist – wie eine Ähre aussieht (Ährenrispengras).
Jedes Ährchen hat an der Basis zwei Hüllspelzen, dann folgt vor jeder Blüte des Ährchens eine Deckspelze, eine Vorspelze und zwei Schwellkörper, die dafür sorgen, dass die Blütenteile bei der Reife auseinandergedrückt werden. Nach innen folgen drei Staubblätter und ein Stempel mit zwei fiederigen Griffelästen. Aus jeder Blüte schieben sich zunächst die Staubblätter mit langen beweglichen Fäden heraus und entlassen viele Pollen. Später entwickeln sich die federartigen Griffeläste mit den Narben die hervorragend zum auffangen der Pollen geeignet sind.
Halm
Die Sprossachse der Gräser ist meist unverzweigt und bildet mehrere auffällige Verdickungen. An diesen Knoten entspringen die wie eine Scheide den Stängel umfassenden Blätter. Nach einigen Zentimetern geht die Blattscheide in die Blattspreite über. An dieser Übergangsstelle finden sich entscheidende Bestimmungsmerkmale: das Blatthäutchen (Ligula) und die Öhrchen. Wenn man an einem Grashalm zieht, reißt er in der Regel an den Knoten, denn dort befindet sich wenig stabiles, teilungsfähiges Gewebe (interkalares Meristem). Im Unterschied zu den meisten anderen Pflanzen können sich die Sprosse wachsenden Gräser an den Knoten strecken und aufrichten, wenn sie vom Wind umgelegt wurden, oder sogar Wurzeln bilden. Das Bildungsgewebe an der Bruchstelle der Sprossachsen schmeckt süß.
Ausgewachsene Grashalme haben im Inneren oft einen Hohlraum (Trinkstrohhalm).
Verzweigungen
Die meisten Grasarten – eine Ausnahme bilden die Bambusse – verzweigen sich nur ganz nahe der Basis oder im Boden. Je nachdem, ob sich die Seitenzweige schnell nach oben krümmen oder ein Stück weit waagrecht wachsen, unterscheidet man Horstgräser, Rasengräser und Ausläufergräser.
Zum Schluss sammeln wir Gräser und ordnen sie entsprechend einem Merkschema.
Zwei weitere mit der Süßgräsern verwandte Familien sind die Sauergräser und die Binsengewächse

Zur Biberburg
Kurz vor der Brücke über den Taldorfer Bach nehmen wir den Weg rechts bergauf in den Wald. Der Weg verläuft etwas oberhalb des Baches. Wir beschäftigen uns mit einigen Pflanzen des Wegrandes zum Beispiel mit den Stickstoffzeigern (Zeigerpflanzen siehe unten) Klebriges Labkraut und Große Brennnessel. Zwischen den Brennnesseln wachsen Wald-Ziest und Hohlzahn, die ohne Blüten den Brennnesseln sehr ähnlich sehen. Andere Beispiele für Pflanzen-Mimikry (Nachahmen der Brennhaar-bewehrten Brennnesseln) sind Taubnesseln und Nesselblättrige Glockenblume.
Schließlich können wir durch das Unterholz die stattliche Biberburg erkennen. Ihre Eingänge liegen unter Wasser, aber die Wohnhöhle liegt über dem Wasser. Möglicherweise finden sich dort gerade junge Biber, denn normalerweise bringen Biber Ende April bis Anfang Mai ihre Jungen zur Welt. Sie bleiben bis zu einem Alter von 4-6 Wochen im Bau. Biber waren früher als Fastenspeise begehrt, da sie wegen ihres Schwanzes zu den Fischen gezählt wurden. Besonders wertvoll war der sehr dichte Biberpelz (23.000 Haare pro cm2, im Vergleich dazu kommt der Mensch nur auf ca. 200 Haaren pro cm2). Ein weiteres wertvolles, von Biber stammendes Handelsgut war das Bibergeil, ein Exkret, das in zwei etwa Hühnerei großen Blasen gesammelt und durch eine Ausführöffnung im Analbereich ausgeschieden wird. Dem Biber dient die Flüssigkeit der Fellpflege und der Reviermarkierung. Die Menschen nutzten sie wegen ihrer Inhaltsstoffe – zum Beispiel Hydroxybenzoesäuren und Abkömmlinge – als Medikament. Die Inhaltsstoffe oder ihre Vorläufer stammen vermutlich aus der pflanzlichen Nahrung des Bibers, zum Beispiel der Rinde von Weiden.
Der Biber ist das größte einheimische Nagetier. Mit seinem kräftigen Nagezähnen kann er große Bäume fällen. Ihre Zweige nutzt er einmal für den Bau seiner Burgen und Dämme, zum anderen dienen Knospen und Rinde als Nahrung. Für den Winter legt er Nahrungszweigdepots im Wasser an.
Zwischen Bast und Borke
Den nährstoffreichen Teil der Rinde, den Bast, der dem Assimilatetransport der Bäume dient, nutzen viele Tiere als Nahrung. Dazu zählen nicht nur Mäuse, Kaninchen, Hasen und Rehe, die an den Bäumen ihre Nagelspuren hinterlassen, sondern auch viel kleinere Tierchen, die Borkenkäfer. Sie gelten als Schwächeparasiten und die trockenen Sommer der vergangenen Jahre haben dazu geführt, dass insbesondere sehr viele Fichten von Borkenkäfern besiedelt wurden. Die rindenbrütenden Borkenkäfer legen ihre Eier unter der Rinde ab und die Larven fressen sich in langsam vergrößernden Gängen in den Bast. Diese Gänge kann man auf der Innenseite abgeschälter Rindenstücke sehr gut als Spuren erkennen. Form und Verlauf dieser Fraßgänge sind von Art zu Art unterschiedlich.

Gangsysteme des Buchdruckrs (Ips typographica) in Fichtenrinde, Teuringer Holz, 29.5.2021, Foto A. Winter
Außerdem gibt es sogenannte holzbrütende Borkenkäfer, deren Larvengänge in den Holzkörper hinein führen. Diese Käfer können sich von dem Holz nur mithilfe von Holz zersetzenden Pilzen ernähren, deren Hyphen die Gänge auskleiden und die sie fressen. Von außen kann man als Spuren dieser Käfer nur die Löcher im Holzkörper sehen. Größere Löcher stammen zum Beispiel von Bockkäfern. Wir finden die schon verlassene Puppenwiege eines Schrotbocks (Rhagium instructor), die aus kreisförmig ausgelegten Holzspänen besteht. Unter der abgestorbenen Rinde und unter den am Boden liegenden Rindenstücken kann man zahlreiche andere Tiere finden, die sich entweder von den organischen Abfallstoffen oder als Beutegreifer ernähren. Uns fallen vor allem zahlreiche Schließmundschnecken, einige Asseln, Tausendfüßler, Spinnen und kleinere sehr flinke Laufkäfer (wahrscheinlich Gattung Pterostichus) auf. Die meisten Borkenkäfer sind vermutlich ausgeflogen, aber wir finden noch einige Exemplare. Bei der Betrachtung durch die Becherlupen erkennen wir, dass an einigen Käfern Milben sitzen, welche die Käfer vermutlich nur als Transportmittel benutzen (phoretische Milben).
Weitere Beobachtungen
In dem Gebiet befinden sich zahlreiche alte Baumstümpe und abgestorbene Bäume. An mehreren Stellen solcher morscher (von Pilzen zersetzter) Stümpfe oder Stämme finden sich tiefe Hacklöcher, die vermutlich vom Schwarzspecht stammen, der regelmäßig im Gebiet zu hören und zu beobachten ist. Einen Pilzfruchtkörper identifizieren wir als Abgeflachten Lackporling (Ganoderma applanatum).

Hackloch eines Schwarzspechts (?) in einem morschen Eichenstamm (Weißfäule). Links sind die Reste eines Fruchtkörpers des Abgeflachten Lackporlings zu erkennen , Teuringer Holz 29.5.2021, Foto A. Winter
Ein typischer Pilzbefall an Rispengras-Halmen (rings um den Halm gehender weißer Belag) kann dem endophytische Pilz Epichloë typhina zugeordnet werden.
Nagelfluh-Kiesgrube
Der für mich mit dem Rollstuhl befahrbare Weg endet an einer verbreiterten Stelle mit steilen Wänden, die in der topographischen Karte als „Teurerer Holz“ markiert ist. Es handelt sich dabei um eine alte Kiesgrube, in der Interstadialer Nagelfluh abgebaut wurde, also verbackene Kiesablagerungen aus einer wärmeren Periode der Würm-Kaltzeit. In der Liste der Geotope im Bodenseekreis findet sich dazu folgende Beschreibung:
Aufgelassene Kiesgrube am Prallhang des Taldorfer Bachs, 1000 Meter östlich von Oberteuringen, an deren Südrand rund fünf Meter mächtige, zu Nagelfluh verfestigte interstadiale Schotter („alte Kiese von Oberteuringen“) zutage treten. Sie sind wahrscheinlich der „Laufenschwankung“, einem großen Rückzugsstadium zwischen Würm I und Würm II zuzuordnen. Der Aufschluss befindet sich am Südrand des Oberteuringer Eisrandtals, das erst später entstanden ist und hier mit einer Breite von etwa 500 Meter einen ehemaligen Gletscherrand markiert.
Geologische Einheit: Quartär
Status: schutzwürdig

Ehemalige Kiesgrube im Teuringer Holz, 29.5.2021, Foto A. Winter
Riedwiesen
Botanisch besonders interessant ist die Riedfläche südlich der Straße, die nach Bibruck bzw. Wammeratswatt führt. Die Fläche wird von Naturschutz regelmäßig aber nicht jährlich gemäht. Wir können verschiedene Knabenkraut-bzw. Fingerwurz-Arten (Dactylorhiza majalis und. D. incarnata) finden, außerdem das Mittlere Zittergras (Briza media), Gelbe Segge (Carex flava) und Hirse-Segge (Carex panicea).
Breitblättriges Knabenkraut (Dactylorhiza majalis) und Mittleres Zittergras (Briza media), NSG Altweiherwiese, 9.5.2021, Fotos A. Winter
Zeigerwerte von Pflanzen
„Die Zeigerwerte sind Kurzbezeichnungen für das ökologische Verhalten, d. h. der Standortsbeziehungen der Pflanzen unter dem Einfluss zahlreicher Konkurrenten“ (Ellenberg 1991).
Pflanzen können Zeiger für bestimmte Standortfaktoren sein. Der Pflanzenökologe und Vegetationskundler Heinz Ellenberg, ordnete ab den 1950er Jahren den mitteleuropäischen Pflanzenarten aufgrund empirischer Erfahrungen Zeigerwerte für sieben verschiedene Umweltfaktoren zu, und zwar für die Standortfaktoren Licht (Lichtzahl), Temperatur (Temperaturzahl), Kontinentalität (Kontinentalitätszahl), Feuchtigkeit (Feuchtezahl), Stickstoff (Stickstoffzahl) und Bodenreaktion,pH-Wert (Reaktionszahl).
URL zur Zeigerwertliste: http://botanik.mettre.de/alpha_liste.shtml
Als Beispiel seien hier die Zeigerwerte von drei Süßgräsern unterschiedlicher Standorte verglichen:
| Art | Standort | L | T | K | F | N | R |
| Taube Trespe (Bromus sterlis) | Wegrand | 7 | 7 | 4 | 4 | X | 5 |
| Glatthafer (Arrhenaterum elatius) | Fettwiese | 8 | 5 | 3 | 5 | 7 | 7 |
| Mittleres Zittergras (Briza media) | Streuwiese bzw. Ried | 8 | X | 3 | X | X | 2 |
Artenliste
(Zusammengestellt von Jenifer Friedrich und Anastaia Winter)
Gräser:
Süßgräser (Poaceae):
Glatthafer (Arrhenatherum elatius)
Kammgras (Cynosurus cristatus)
Wohlriechendes Ruchgras (Anthoxanthum odoratum)
Wolliges Honiggras (Holcus lanatus)
Gewöhnliches Rispengras (Poa trivialis)
Taube Trespe (Bromus sterilis) (Ruderalgras)
Weiche Trespe (Bromus hordaceus)
Wiesen-Fuchsschwwanz (Alopecurus pratensis)
Wiesen-Schwingel (Festuca pratensis)
Hunds-Quecke (Elymus caninus)
Fieder-Zwenke (Brachypodium pinnatum)
Mittleres Zittergras (Briza media)
Sauergräser (Cyperaceae):
Steife Segge (Carex elata)
Zittergras-Segge (Carex brizoides)
Wald-Segge (Carex sylvatica)
Gelbe Segge (Carex flava)
Hirsen-Segge (Carex panicea)
Binsengwächse (Juncaceae):
Feld-Hainbinse( auch Hain“simse“, aber „Simsen“ kommen auch bei der Familie Sauergräser vor) (Luzula campestris agg., Sammelart, unsere Pflanze war vermutlich L. multiflora))
Andere Pflanzen, Sträucher, Bäume:
Wolliger Schneeball (Viburnum lantana)
Gewöhnlicher Schneeball (Viburnum opulus)
Europäisches Pfaffenhütchen (Euonymus europaeus)
Rot-Fichte(Picea abies)
Stiel-Eiche (Quercus robur)
Rot-Buche (Fagus sylvatica)
Gewöhnlicher Haselstrauch (Corylus avellana)
Hänge-Birke (Betula pendula)
Schwarz-Pappel (Populus nigra)
Silber-Weide (Salix alba)
Schöllkraut (Chelidonium majus)
Hohlzahn (Gattung Galeopsis)
Große Brennnessel (Urtica dioica)
Wald Ziest (Stachys sylvatica)
Echte Nelkenwurz (Geum urbanum)
Ross-Minze (Mentha longifolia)
Waldmeister (Galium odoatum)
Klebriges Labkraut (Galium aparine)
Gamander-Ehrenpreis (Veronica chamaedrys)
Wiesen-Pippau (Crepis biennis)
Wiesen-Schaumkraut (Cardamine pratensis)
Breitblättriges Knabenkraut (Dactylorhiza majalis)
Fleischfarbenes Knabenkraut (Dactylorhiza incarnata)
Pilze
Birkenporling (Fomitopsis betulina)
Flacher Lackporling (Ganoderma applanatum, syn. Ganoderma lipsiense)
Tiere:
Europäischer Biber (Castor fiber))
Schneeballblattkäferlarve (Pyrrhalta viburni)
Schrotbock (Rhagium inquisitor)
Borkenkäfer (Scolytinae)
Larve einer Schaumzikade(Familie Aphohoridae) in Schaumhülle („Kuckucksspeichel“)
Zilp-Zalp ,Weiden-Laubsänger, (Phylloscopus collybita)
Buchfink (Frinilla coeleps)
Eichelhäher (Garrulus glandarius)
12. Juni 2021 Völlkofen
Treffpunkt: Völlkofen, Grillhütte 10.00h

3. Juli 2021 Naturschutzzentrum Wilhelmsdorf
Treffpunkt am Naturschutzzentrum Wilhelmsdorf


Das Naturschutzzentrum liegt am nördlichen Rand von Wilhelmsdorf
Naturschutzzentrum Wilhelmsdorf im Pfrunger-Burgweiler Ried
Frau Margit Ackermann, Diplombiologin und Naturpädagogin und seit 2006 Mitarbeiterin des Naturschutzzentrums Wilhelmsdorf, gibt uns einen Einblick in Ziele und Aufgaben des Naturschutzzentrums und ihrer Arbeit. Das Zentrum wurde 1994 unter der privaten Trägerschaft des Schwäbischen Heimatbundes e. V. gegründet und mit Unterstützung des Landes Baden-Württemberg und der Gemeinde Wilhelmsdorf als Informationszentrum eingerichtet. 2016 übernahm die Stiftung Naturschutz Pfrunger-Burgweiler Ried die Trägerschaft. Neben den pädagogischen Aufgaben – Information der Öffentlichkeit Besucherangebote – geht es um Beobachtung und Dokumentation von Flora und Fauna, Durchführung von Artenschutzmaßnahmen, Organisation und Koordination von Pflegemaßnahmen einschließlich der extensiven Beweidung sowie der Flächenverwaltung und Verkehrssicherung. Derzeit läuft ein Verfahren zur Anerkennung des Pfrunger-Burgweiler Rieds als UNESCO-Biosphärenreservat.
Entstehungsgeschichte des Pfrunger-Burgweiler Rieds
In dem 2012 erstellten Ausstellungs- und Veranstaltungsgebäude versammeln wir uns vor einem Luftbild, in dem das Pfrunger-Burgweiler Ried mit Blick nach Süden – Bodensee und Alpen im Hintergrund – zu sehen ist. Vor 20.000 Jahren, beim Hochstand der letzten Kaltzeit (Würm-Kaltzeit) füllte eine Zunge des Rheingletschers das Tal zwischen den heutigen Orten Wilhelmsdorf und Ostrach. Beim Rückzug des Gletschers blieb am nördlichen Rand eine Endmoräne zurück (Äußere Würm-Endmoräne). In Höhe des heutigen Wilhelmsdorf kam es vor etwa 15.000 Jahren zu einem Stillstand der Gletscher-Rückentwicklung, eventuell auch einem weiteren Gletschervorstoß. In jedem Fall befand sich dort längere Zeit ein Gletscherrand und es lagerte sich Moränenmaterial ab (Innere Würm-Endmoräne). Das Schmelzwasser sammelte sich in dem Becken bis zur Endmoräne beim heutigen Ostrach, die den Abfluss nach Norden behinderte. Nach weiterem Abschmelzen wurde der Abfluss nach Süden durch die südliche Endmoräne blockiert, sodass ein Eisstausee erhalten blieb, in dem sich zunächst feines Tonmaterial ablagerte und den See nach unten abdichtete. Der Zufluss kalkreichen Wassers aus den umgebenden Höhenzügen, die teilweise aus interstadialen kalkreichem Nagelfluh aufgebaut sind, führte zur Ablagerung einer Seekreideschicht, das einsetzende Wachstum von Planktonalgen ließ eine erste Ablagerung mit hohem Anteilan organischen Material entstehen, die wegen ihrer braungrünen Farbe und der elastischen Eigenschaften als Lebermudde bezeichnet wird. Das mit der Klimaerwärmung zunehmende Pflanzenwachstum lieferte das Material für weitere Sedimente mit hohem organischem Anteil und Niedermoortorf. Im Laufe der Jahrtausende wurde der See dadurch immer flacher und aufgrund geringen Nährmineralgehalts und der hohen Regenmengen konnten sich auf den verlandenden Bereichen erste Torfmoose ansiedeln. Damit begann die Entwicklung zum Hochmoor.

Alt: Altshause, Ebb: Ebersbach, Ebw: Ebenweiler, Ech: Echbeck, Fle: Fleischwangen, Fro: Fronhofen, Gug: Guggenhausen, Has: Hasenweiler, Hoß: Hoßkirch, Ill: Ilmensee. Kön: Königseggwald, Ost: Ostrach, Wal: Waldbeuren, Wil: Wilhelmsdorf
Der Illmensee und der Lengenweiher gehen auf Toteislöcher zurück, ursprünglich vom Gletscherrand abgetrennte Eispartien, die zunächst von Sediment überdeckt wurden und dann nach Abschmelzen wassergefüllte „Löcher“ bildeten.
Die Entwicklung bis zum heutigen Landschaftsbild wurde sehr stark durch menschliche Einflüsse geprägt. Nach der Gründung der Gemeinde Wilhelmsdorf durch württembergische Pietisten (Herrnhuter Brüdergemeinde) unter der Obhut des württembergischen Königs Wilhelm I. im Jahre 1824 wurde mit der Entwässerung und Kultivierung des Moorgebietes begonnen. Im 20. Jahrhundert wurde kurze Zeit ein intensiver industrieller Torfabbau betrieben. Diese Torfgruben sind bis heute als offene Wasserflächen erhalten.
Exkursion zum Hochmoorrest Eulenbruck

Um einen Eindruck einer typischen Hochmoorlandschaft zu bekommen unternehmen wir eine Exkursion zum Eulenbruck. Wir folgen zunächst dem Asphaltssträßchen Richtung Lindenhof und biegen dann links ab und noch einmal links in den Kiefern-Moorwald mit einem dichten Unterwuchs aus Heidelbeeren (grüne Sprossachsen), an einigen Stellen auch Rauschbeeren (braune Sprossachsen). An einigen besonders feuchten Stellen kann man erste Ansiedlungen von Torfmoosen beobachten. Die Torfmoos-Pflänzchen haben einen typischen Aufbau aus Hauptachse (Stamm) und zu mehreren angeordneten dicht mit Blättchen besetzten Seitentrieben . Einige Seitenästchen laufen am Stämmchen herab und verleihen diesem eine dochtartige Struktur (Abb.).
Über einen Steg erreichen wir eine Aussichtsplattform, die den Blick auf einen relativ intakten Hochmoorbereich freigibt. Die geschlossene Torfmoosdecke, die wie ein Schwamm Wasser aufsaugt und festhält, wächst kontinuierlich nach oben, während die unteren Teile absterben und nur sehr langsam abgebaut werden. Dadurch entsteht kontinuierlich ein Zuwachs an Torf, in unserem Klima etwa 1 mm pro Jahr. Das bedeutet, dass in den 10.000 Jahren seit dem Ende der letzten Eiszeit maximal 10 m Torf gebildet werden konnte. Tatsächlich haben Bohrungen gezeigt, dass die Torfschichten unter dem Eulenbruck diese Mächtigkeit haben.
Durch einen Versuch demonstriert Margit Ackermann das schwammartige Wasseraufnahmevermögen von Torfmoosen. Aus einer Handvoll Torfmoose ausgepresstes Wasser wird in Sekundenschnelle wieder aufgenommen. Durch Auspressen gewinnt man allerdings nur einen Teil des in Torfmoosen gespeicherten Wassers, der größere Teil ist in einem Netz aus toten Wasserspeicherzellen in Blättchen und Stämmchen gespeichert, insgesamt das bis zu 30fache des Trockengewichts (Abb.). Da das gespeicherte Wasser nur aus dem Regen stammt, enthält es sehr wenig Mineralstoffe. Zudem haben Torfmoose die Fähigkeit, Mineralstoff-Kationen (K*; Ca++ u.a.) gegen H+-Ionen auszutauschen. Dadurch wird das Wasser stark abgesäuert. Wir messen in dem ausgepressten Wasser einen pH-Wert von ca. 4,0.

Für Gefäßpflanzen sind Hochmoore deshalb ein sehr extremer Standort, weshalb hier nur wenige charakteristische Arten vorkommen. Die Heidekrautgewächse Moosbeere und Rosmarinheide können mithilfe ihrer Mykorrhizapilze und aufgrund ihres langsamen Wachstums hier gedeihen. Der Rundblättrige Sonnentau bessert seine Stickstoffversorgung durch Insektenfang und -verdauung auf (Carnivore Pflanze).


Am Birkenaufwuchs und der stark aufkommenden Besenheide kann man erkennen, dass der Wassergehalt des Hochmoores einen kritischen Punkt erreicht hat. Die beiden letzten sehr trockenen Sommer konnten durch den diesjährigen bisher ziemlich regenreichen Sommer noch nicht ausgeglichen werden. Die Austrocknung bedeutet, dass die Zersetzung der organischen Materialien unter Sauerstoffeinfluss rascher voranschreitet . Das bedeutet nicht nur, dass das Moor nicht mehr in die Höhe wächst, sondern dass auch die tieferen Schichten abgebaut werden und der so über Jahrhunderte gespeicherte Kohlenstoff wieder als CO2 freigesetzt wird. Dies ist der Hauptgrund dafür, dass man angesichts der CO2-bedingten Klimaerwärmung Hochmoore unter besonderen Schutz gestellt hat.

Insekten
Zurück am Naturschutzzentrum werden wir von schwärmenden Honigbienen empfangen. Wir entdecken eine Schwarmtaube an einem der Findlinge, die vor dem Naturschutzzentrum aufgestellt wurden. Der mit dem Naturschutzzentrum zusammenarbeitende Imker und Lehrbeauftragter der PH Weigarten, Herr Guggolz,wird informiert.
Nach wir eine kleinen Getränkepause und beschäftigen wir uns dann mit der Gruppe der Insekten, die aufgrund der zahlreichen Berichte über den dramatischen Rückgang ihrer Arten und Individuen im besonderen Interesse der Öffentlichkeit steht. Der starke Rückgang der Insekten-Biomasse ist mittlerweile so auffällig, dass er auch von Laien und der Entomologie fernstehenden Personen nicht mehr übersehen werden kann. Der starke Rückgang des Singvogelbestandes und insbesondere der Fledermäuse dürfte eine direkte Folge dieser Entwicklung sein. Auch die Ursachen sind nicht wirklich ein Geheimnis. Da ist erst einmal der hohe Pestizideinsatz in der Landwirtschaft zu nennen, andererseits aber auch der Verlust geeigneter Lebensräume mit einer vielseitigen Flora. Mit Blumenstreifen an Ackerrändern versucht man, einen Ausgleich zu schaffen. Da diese aus Saatmischungen stammenden Pflanzen häufig exotische, oft einjährige Arten enthalten stehen sie allerdings in der Kritik. Auch die Nähe zu den gespritzten Äckern und der Mangel an Brutmöglichkeiten und Nahrungspflanzen für die Larven der Insekten mindert den ökologischen Wert der bunten Ackerrandstreifen.
Eine wichtige Voraussetzung dafür, dass Insektenschutzmaßnahmen in der Öffentlichkeit breite Zustimmung finden, ist eine bessere Kenntnis der Insekten. Deshalb sind sie ein wichtiges Thema für den Biologieunterricht.
Dass man mit dem Thema durchaus Begeisterung wecken kann, beschreibt Dave Goulson in seinem Buch „Die seltensten Bienen der Welt“: „Es war ein sonniger Nachmittag gegen Schuljahresende im Juni 2009, und ich ging mit der Klasse meines ältesten Sohns Finn an der Newton Primary School Dunblane auf Insektenjagd….. Als wir am Wald waren, reichte ich den eifrigen Sieben- und Achtjährigen Netze und sonstiges Material und zeigte ihnen, wie man sie verwendet. … Einen Wiesenkescher zu öffnen, ist immer eine spannende Sache – wie bei den hübsch verpackten Geschenken unter dem Weihnachtsbaum weiß man nie, was Wunderbares drinsteckt. Unter lautem Ah und Oh sahen die Kinder zu, wie Scharen winziger Tiere – Ameisen, Spinnen, Wespen, Käfer, Fliegen und Raupen – aus dem Netz krabbelten, flogen und hüpften. Ich zeigte ihnen, wie man die kleinsten, empfindlichsten von ihnen in einen Exhaustor saugt. Dann verteilte ich eine Handvoll Becher, in denen jeder seinen Fang sammeln konnte, und die Kinder schwärmten aus, rannten durchs Unterholz, wedelten, kescherten und saugten nach Herzenslust, die Augen vor Aufregung weit aufgerissen. …“. Diese Beschreibung stammt aus dem Jahre 2009. Die Ergebnisse unserer Fangversuche waren deutlich schlechter – ein bisschen lag das vielleicht daran, dass die Witterung ziemlich schwül und wir durch unsere Exkursion schon etwas erschöpft waren, aber nicht nur. Ich habe mit Studierenden der PH Weingarten hier in Wilhelmsdorf zum ersten Mal 2017 Wieseninsekten gefangen und da waren unsere Ergebnisse deutlich vielseitiger. Auch die Fänge der parallel arbeitenden Wasserinsekten-Fanggruppe waren vergleichsweise dürftig (vgl. Artenliste).
Mittlerweile ist der Imker zu seinen Bienen gekommen und dadurch ergibt sich die Gelegenheit, aus erster Hand Informationen über dieses wichtigste Nutztier aus der Klasse der Insekten zu bekommen.
Die über 40.000 (immer noch?) mitteleuropäischen Insektenarten zu kennen, ist unmöglich, aber nicht so schwierig ist es, die wichtigsten 15-20 Ordnungen einheimischer Insekten zu erkennen und dann mithilfe eines Bestimmungsbuches auch einige Arten herauszufinden. Mir hilft dabei oft das mittlerweile leider schon längere Zeit vergriffene „Parays Buch der Insekten“ von Michael Chinery. Die über 2300 in diesem Buch mit sehr guten, treffenden Zeichnungen dargestellten Arten stellen nach meiner Erfahrung eine ausgezeichnete Auswahl dar, die zwar ursprünglich für Großbritannien getroffen wurde, aber auch für Mitteleuropa gilt.
Für Unterrichtszwecke hat Ulrich Kattmann eine Einteilung der Insekten in „Elfen, Ritter und Gaukler“ vorgeschlagen (vgl. Abb.)


Die systematische Einteilung der Insekten nach Verwandtschaftsgruppen unterscheidet
- ursprünglich flügellose Ordnungen, zu denen zum Beispiel Springschwänze und Silberfischen gehören,
- Insekten mit unvollkommener Verwandlung, bei denen zwischen Larvenstadium und voll ausgebildeten Insekt (Imago) kein Puppenstadium eingeschoben ist, (zum Beispiel Libellen, Heuschrecken und Schaben) und
- Insekten mit vollkommener Verwandlung (Ei – Larve – Puppe – Imago), zu denen zum Beispiel Käfer, Schmetterlinge und Hautflügler gehören.
Die meisten Bäume des Moorwaldes sind Wald-Kiefern (kenntlich an der braunrötlichen Färbung der oberen Stammbereiche), dazwischen stehen aber auch immer wieder Moor-Kiefern (mit durchgehend braunschwärzlichen Stämmen). Außerdem gedeihen hier Moor-Birken, die sich von Hänge-Birken durch die aufrechteren Zweige und die Behaarung der jungen Triebe unterscheiden.
Liste der beobachteten Pflanzenarten, chronologisch geordnet
(zusammengestellt von Darius Targan)
| Name | Wissenschaftlicher Name |
| Echtes Mädesüß | Filipendula ulmaria |
| Echter Baldrian | Valeriana officinalis |
| Gewöhnlicher Blutweiderich | Lythrum salicaria |
| Sumpf-Hornklee | Lotus pedunculatus |
| Heidelbeere | Vaccinium myrtillus |
| Rauschbeere | Vaccinium uliginosum |
| Rosmarinheide | Andromeda polifolia |
| Hain-Gilbweiderich | Lysimachia nemorum |
| Wiesen-Wachtelweizen | Melampyrum pratense |
| Gewöhnliche Moosbeere | Vaccinium oxycoccos |
| Rundblättriger Sonnentau | Drosera rotundifolia |
| Roter Fingerhut | Digitalis purpurea |
| Kohl-Krazdistel | Cirsium oleraceum |
| Moor-Kiefer; Spirke, Moorspirke | Pinus mugo ssp. rotundata |
| Wald-Kiefer | Pinus sylvestris |
| Moor-Birke | Betula pubescens |
| Rasen-Schmiele | Deschampsia cespitosa |
| Wiesen-Lieschgras | Phleum pratense |
| Flutender Schwaden | Glyceria fluitans |
| Wald-Simse | Scirpus sylvaticus |
| Gewöhnlicher Dornfarn | Dryopteris carthusiana |
| Torfmoos | Sphagnum |
Liste einiger beobachteter Tierarten
Säugetiere
Europäischer Biber (Castor fiber) -Biberausstiieg – Biberrutsche – am Weg begleitenden Bach
Vögel
Goldammer
Buchfink
Mönchsgrasmücke
Rabenkrähe
Insekten an Land
Brennnesselzünsler (Anania hortulata, Syn.: Eurrhypara hortulata): eingefaltete Brennnesselblätter lassen erkennen, dass sich hier Raupen eingesponnen hatten.
Landkärtchen (Araschnia levana) : Sommergeneration des Falters und Raupe
Kleiner Fuchs (Aglais urticae)
Brauner Waldvogel, Schornsteinfeger (Aphantopus hyperantus)
Grasmotte (Fam. Crambidae – Rüsselzünsler)
Kohlweißling (Pieris brassicae)
Baumwanze (Fam. Pentatomidae)
Kugelwanze (Coptosoma scutellata)
Schaumzikadenlarve (Fam. Cercopidae)
einige Schwebfliegen (Fam.Syrphidae, z. B. Episyrphus balteatus)
Raubfliege (Fam. Asselidae) mit Beute
Wasserinsekten und andere Wassertiere
Kleinlibellenlarven
Eintagsfliegenlarven
Büschelmückenlarven, „Glasstäbchen“ (Fam. Chaoboridae)
Zuckmückenlarve (Fam. Chironomidae)
Rückenschwimmer (Notonecta glauca)
Muschelkrebse (Ostracoda)
Süßwassermilben (Hydrachnidiae)
24. Juli 2021 Naturschutzzentrum Wilhelmsdorf
Die Anfahrt nach Wilhelmsdorf wird durch einige Gewitter und lokale Starkregen beeinträchtigt, wodurch einige Teilnehmer*innen abgeschreckt werden.
Der Abend beginnt im Unterrichtsraum des Naturschutzzentrums und er steht ganz unter dem Thema „Fledermäuse“. Diese außergewöhnliche Verwandtschaftsgruppe fliegender Säugetiere ist ein besonderer Schwerpunkt in der Arbeit des Naturschutzzentrums Wilhelmsdorf. Es geht dabei nicht nur um den Schutz und die Dokumentation der im NSG Pfunger-Burgweiler Ried vorkommenden Arten sondern auch um die Vermittlung von Wissen und den Abbau von falschen Informationen über die Flatterttiere. Frau Margit Ackermann führt uns in abwechslungsreicher und spannender Form in die Biologie der Fledermäuse ein. Dabei kommen verschiedene Spiele (Memory, Puzzle, Zuordnungsspiele), Anschauungsmaterial, ein Video und eine PowerPoint Präsentation zum Einsatz. Schließlich werden vier „Säuglinge“ der Zwergfledermaus (Pipistrellus pipistrellus)aus einer mit Tüchern abgedunkelten Box geholt und mithilfe einer Spezial-Minipipette und angerührter Milch für Hundewelpen gefüttert. Vor der Fütterung werden die Kleinen mithilfe einer Wärmflasche aufgewärmt um sie beweglicher zu machen.

Zum Abschluss – es ist mittlerweile 21:15 Uhr und beginnt langsam dunkel zu werden – wollen wir einige Fledermäuse in freier Natur erleben. Dabei helfen Fledermaus-Detektoren, durch welche die Ultraschall-Echolot-Signale der Fledermäuse in für uns hörbare Laute übertragen werden. In einem der beiden uns zur Verfügung stehenden Geräte werden nicht nur die Töne übersetzt, im Display wird auch noch ein Sonagramm (auch Sonogramm genannt) dargestellt, das den zeitlichen Verlauf der Lautäußerungen gegen die Frequenz aufzeichnet. Bei manchen Geräten wird auch noch die Lautstärke durch unterschiedliche Farben dargestellt.
Wir gehen vom Unterrichtsraum zum Bürogebäude des Naturschutzzentrums, an dessen Wänden verschiedene Fledermauskästen bzw. Fledermausbretter aufgehängt sind. Kaum stehen wir davor, wird schon die erste Fledermaus beobachtet, die Margit Ackermann mit dem Detektor als Zwergfledermaus identifiziert. Danach können wir längere Zeit einen großen Abendsegler am Himmel beobachten und mit dem Detektor hören. Wir wandern dann über die Straße und einen Weg zu einem größeren See und dort hören und sehen wir Zwergfledermaus, Wasserfledermaus und Großen Abendsegler, die meist dicht über die Wasseroberfläche fliegen.
Auf dem Rückweg taucht überraschend ein Biber vor uns auf und verschwindet später mit großem Platsch im Wasser.
Pflanzenfamilien erkennen
Je nach Zählung gibt es in Mitteleuropa mindestens 3000 verschiedene Pflanzenarten. Aber auch wenn viele davon selten sind oder nur in ganz bestimmten Gebieten vorkommen, so ist erscheint dem Laien auch die Anzahl von verschiedenen Pflanzenarten in der näheren Umgebung ziemlich unüberschaubar. Ganz allgemein gilt, dass man sich viele unterschiedlichen Objekte leichter merken kann, wenn man sie in Gruppen einteilt. Manche Pflanzenbestimmungsbücher nutzen hierfür zum Beispiel die Blütenfarben, andere Einteilungsmöglichkeiten sind der Lebensraum oder der Blühzeitraum. Eine Möglichkeit, die auch von Botanikern genutzt wird, ist die Einteilung nach der Verwandtschaft.
Die ersten Lebewesen auf der Erde sind vor mehr als 3 Milliarden Jahren entstanden. Alle heutigen Erdbewohner stammen von Ihnen ab und sind deshalb miteinander verwandt, aber nicht in gleichem Maße: Es gibt nähere und entferntere Verwandtschaften. Nahe verwandte und deshalb meist ähnliche Arten fasst man zu Gattungen, ähnliche Gattungen zu Familien zusammen, diese dann weiter zu Ordnungen, Klassen und Abteilungen.
Beispiel für die systematische Einordnung der Echten Nelkenwurz
Abteilung: Samenpflanzen
Klasse: Bedecktsamer Nacktsamer
Ordnung: Rosenartige Magnolienartige …
Familie:. Rosengewächse Brennnesselgewächse …
Gattung: Nelkenwurz Erdbeere …
Art: Echte Nelkenwurz Bach-Nelkenwurz …
Für das Bestimmen und Wiedererkennen von Pflanzen sind die Familien, in manchen Fällen auch die Gattungen, besonders wichtig und hilfreich. Wenn man die acht in den Kästchen vorgestellten, in der heimischen Flora häufigen Familien wiedererkennt, wird der Einstieg in die Artenkenntnis der Pflanzen leichter.




Quellen:
Beran, F. (2002): Die Entstehung des Natur- und Lebensraumes am nördlichen Bodenseeufer und um Oberteuringen. In: Gemeinde Oberteuringen (Hrsg., 2002): Teuringen. Ein Streifzug durch die Jahrhunderte, S.13-23.
Elenberg, H. (1991): Zeigerwerte der Gefäßpflanzen (ohne Rubus). In: Ellenberg, H. et al. (1991): Zeigerwerte von Pflanzen in Mitteleuropa. Scripta Geobotanica XVIII. Göttingen: E. Goltze
und die Materialien zu den früheren Exkursionen für die PH Weingarten ab 2016